量化血流动力学新时代:以数据驱动重构临床决策的精准与高效
血流动力学监测是重症医学、心血管疾病诊疗等领域的“生命线”——通过评估心脏功能、血管阻力、组织灌注等核心指标,为疾病诊断、治疗方案制定及预后判断提供关键依据。然而,传统血流动力学监测手段长期面临“主观性强、操作复杂、依赖经验”的痛点,制约着临床决策的精准度与效率。随着量化技术的突破,以“客观数据”替代“主观判断”的量化血流动力学新时代已到来,其核心价值在于通过标准化、可量化的指标体系,减轻医生负担、消除主观偏差,为临床决策注入“数据驱动”的确定性。
传统血流动力学监测的痛点:主观性、复杂性与侵入性的三重桎梏
在量化技术普及前,临床血流动力学评估无论是无创还是有创手段,均存在显著局限,共同制约着监测的精准度与效率。
1. 主观判断主导,结果一致性差
传统无创监测手段中,许多关键指标依赖医生对图像、波形的“定性解读”。以心肌收缩力评估为例,心脏超声需通过“室壁运动分析”判断心肌收缩功能——医生观察左心室各节段室壁的运动幅度、增厚率及协调性,进而分级(如正常、运动减低、无运动)。但这一过程受图像质量(如肺气干扰、肥胖患者成像模糊)、医生经验(不同年资医生对“运动减低”的界定差异)等因素影响,不同中心、不同医生间的评估一致性常不足60%,易导致误诊或治疗延迟。
2. 操作复杂耗时,医生负担沉重
传统技术不仅主观,还伴随复杂的操作与数据分析流程。心脏超声完整的室壁运动分析需医生手动勾勒心内膜边界、逐节段评分,单例患者分析耗时10-15分钟;若结合射血分数、E/E'比值等指标,时间进一步延长。在ICU等高强度场景中,医生需同时管理多名危重患者,此类“高耗时操作”会加剧工作负担,甚至因时间紧迫简化评估,牺牲数据完整性。
3. 有创监测的侵入性风险与操作门槛
部分传统监测依赖有创手段(如肺动脉导管、动脉导管)获取量化数据,但存在“侵入性风险高、操作门槛高”的局限:
侵入性并发症:肺动脉导管(PAC)需经颈内/锁骨下静脉置入右心至肺动脉,可能引发心律失常、感染、肺动脉破裂等并发症,严重时危及生命;
操作门槛高:需专业医生操作,且置入后需持续校正零点、排除呼吸干扰(如机械通气患者需在呼气末记录数据),数据解读复杂;
动态监测受限:有创监测多为“间歇性采样”(如每小时记录一次心输出量),难以捕捉血流动力学的快速变化(如术后急性心衰的骤发)。
例如,PAC虽能提供心输出量、肺动脉楔压等量化指标,但因上述局限,其临床应用已逐渐被无创量化技术替代。
这些痛点共同指向一个核心问题:传统模式下,“主观性”“复杂性”“侵入性”相互叠加,使血流动力学监测成为临床决策的“不确定环节”。而量化血流动力学的崛起,正是通过“无创化、自动化、指标量化”破解这一困局。
量化血流动力学的核心价值:以“数据标准化”实现“减负”“去主观化”与“无创化”
量化血流动力学的本质,是通过技术创新将传统“定性描述”或“有创采样”的指标转化为无创、可直接测量、数值化呈现、标准化解读的量化参数。其核心优势体现在三大维度:
1. 减轻医生负担:从“手动操作”到“自动输出”,释放人力成本
量化技术通过集成传感器、算法模型与自动化分析系统,将传统需“人工操作、主观判断”的流程转化为“一键式数据输出”。例如,阻抗法血流动力学监测技术(如BioZ)通过贴敷于胸腔的电极片,持续监测胸腔阻抗变化,结合心电、血压信号,自动计算心输出量、外周血管阻力、心肌收缩力等核心指标,全程无需医生手动干预,单例患者监测数据获取时间从传统技术的10分钟以上缩短至30秒内。这种“自动化、标准化”的流程,大幅减少了医生在数据采集与初步分析上的时间投入,使其能聚焦于更核心的临床决策环节。
2. 消除主观偏差:以“客观数据”替代“经验判断”,提升结果可靠性
量化指标的最大价值在于“客观性”——通过物理原理(如阻抗变化、压力波形特征)直接计算指标数值,避免人为解读的不确定性。例如,心肌收缩力的量化指标(如BioZ的ACI)、容量状态的量化参数(如BioZ的TFC)等,均以具体数值呈现,结果不受医生经验、操作习惯或视觉误差影响,不同场景、不同操作者间的一致性可达90%以上。这种“数据说话”的模式,为多中心研究、远程会诊及标准化诊疗提供了统一的“语言”。
3. 无创化监测:规避有创风险,实现动态连续评估
量化技术以“无创”为核心优势,通过体表传感器(如电极片、指套)采集信号,避免有创操作的并发症风险。同时,量化监测支持“连续动态监测”(如每2秒更新一次数据),可实时捕捉血流动力学的细微变化(如术后急性心肌收缩力下降、容量负荷过重的早期预警),为治疗调整提供“实时反馈”。
从“室壁运动”到“ACI”,从“胸片估肺水”到“TFC”:BioZ量化指标如何重塑血流动力学评估?
量化血流动力学的优势,可通过BioZ的核心量化指标直观体现——其基于阻抗法原理,不仅实现了心肌收缩力的量化(ACI),还创新推出胸腔液体含量(TFC)等独有的容量评估指标,使血流动力学评价从“单一维度”走向“多维度整合”。
1. ACI:心肌收缩力的“量化锚点”,阻抗法独有的心肌功能指标
心肌收缩力是反映心脏泵血功能的核心指标,传统心脏超声依赖“室壁运动主观分级”,而BioZ通过阻抗法直接量化心肌收缩力,核心指标为ACI(Acceleration Index,加速度指数):
定义:主动脉血流加速度的峰值,单位为m/s²,反映心肌收缩的“爆发力”——ACI越高,心肌收缩力越强;
优势:
o 完全客观量化:由设备通过算法自动计算,数值化呈现(如正常范围:男性70-150,女性90-170),无需医生主观判断;
o 无创连续监测:电极片贴敷即可,每2秒更新一次数据,可捕捉心肌收缩力的快速变化(如正性肌力药物起效后的10分钟内数值升高);
o 结果稳定可靠:不受图像质量、医生经验影响,不同操作者间一致性>90%。
例如,一名感染性休克患者,传统超声因“整体室壁运动减低”难以区分是心肌抑制还是容量不足;而BioZ监测显示ACI显著降低(如男性患者ACI=50 <70),结合心输出量指标,可快速判断为“心肌收缩力衰竭”,指导精准使用多巴酚丁胺治疗。
2. TFC:胸腔液体含量的“量化标尺”,容量评估的无创突破
容量状态评估(如胸腔内血容量、肺水)是血流动力学监测的另一核心,传统依赖胸片(主观判断肺淤血程度)或有创的血管外肺水指数(EVLWI,需PiCCO导管),而BioZ通过TFC(Thoracic Fluid Content,胸腔液体含量)实现无创量化:
定义:基于胸腔阻抗变化计算的胸腔内液体总量(包括血液、肺水、组织间液),反映整体容量负荷状态;
优势:
o 无创替代胸片:胸片需搬动患者(危重患者风险高),且“肺淤血程度”依赖医生主观判断(如“轻度/中度肺淤血”),而TFC以数值量化(如正常范围30-50),结果客观;
o 动态反映容量变化:输液或利尿剂治疗后,TFC可在30分钟内出现显著变化(如利尿剂起效后TFC从45 降至38 ),指导容量调整;
o 联合ACI实现多维度评估:TFC(容量)+ ACI(心肌收缩力)+ 心输出量(CO)+ 外周血管阻力(SVR),形成“心肌-容量-血管”的完整血流动力学评估体系。
例如,一名急性心衰患者,传统胸片提示“双肺模糊影”(主观判断肺水增多),而BioZ监测女性TFC=48 L,结合ACI=90(正常范围),可判断为“容量负荷过重”,指导利尿剂精准使用,避免盲目强心治疗。
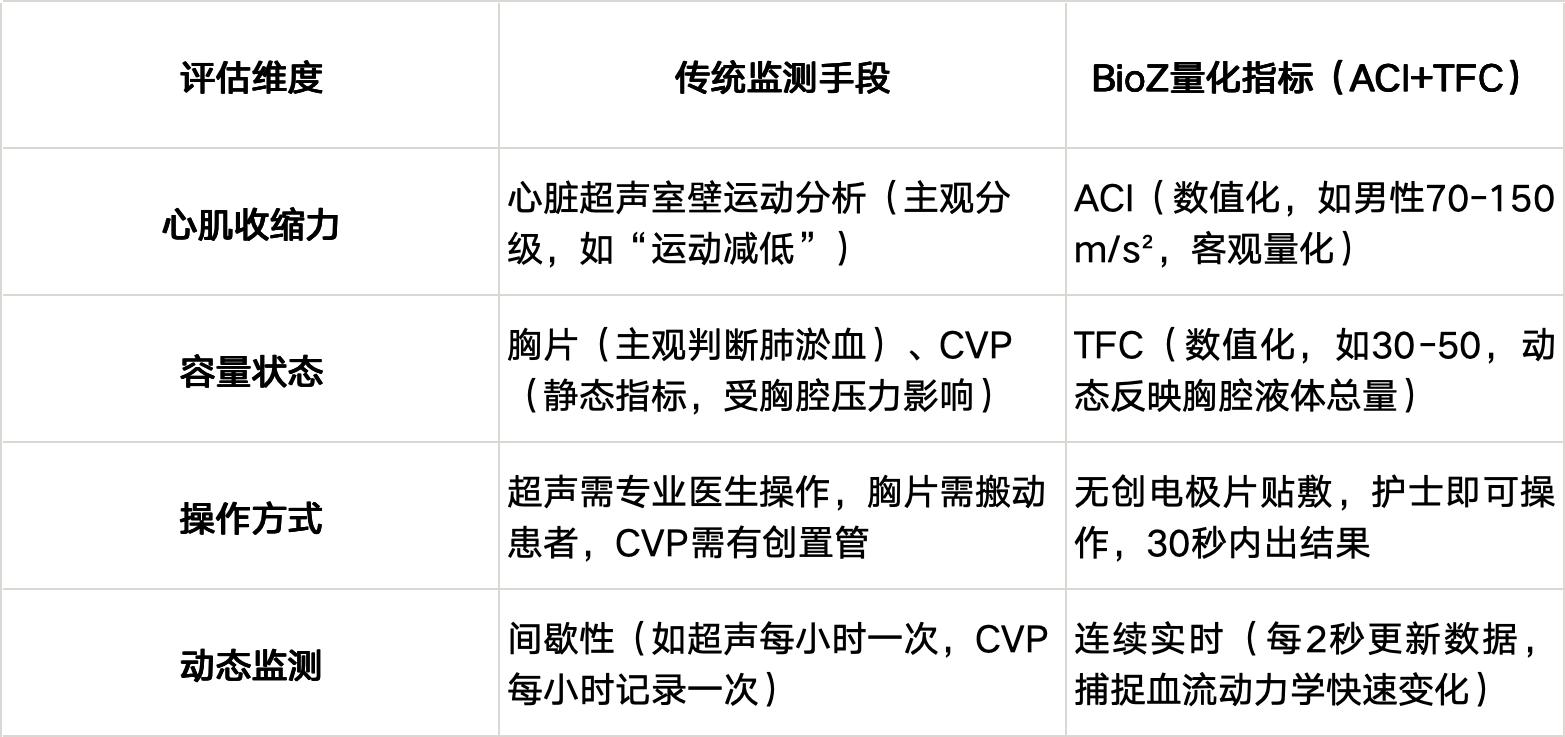
对比:传统监测与BioZ量化指标的核心差异
通过ACI与TFC的协同,BioZ将心肌收缩力与容量状态的评估从“模糊定性”升级为“精准量化”,不仅减轻了医生的操作与分析负担,更以“客观数据”消除了主观偏差,使血流动力学评估成为临床决策的“确定性依据”。
量化血流动力学的未来:从“指标量化”到“全程智能”
量化血流动力学的价值远不止于单一指标的突破,其正在推动整个监测体系向“多维度整合、AI辅助决策”演进。未来,随着AI算法、多模态数据融合技术的发展,量化监测将实现三大升级:
实时预警:结合ACI、TFC等连续量化数据与AI模型,自动识别血流动力学异常(如ACI骤降+TFC骤升提示急性心衰),提前5-10分钟预警病情恶化;
精准分型:通过“ACI+TFC+CO+SVR”多指标组合,实现休克、心衰等疾病的精准分型(如“低ACI+低CO+高SVR”提示心源性休克),指导个体化治疗;
预后预测:基于长期量化数据建立预后模型(如ACI持续<正常下限的患者死亡率升高3倍),为风险分层提供依据。
结语:以量化之力,开启精准医疗新征程
量化血流动力学的崛起,是“数据驱动”对“经验驱动”的革新,更是“无创化”对“有创化”的替代。从心脏超声的“室壁运动主观判断”到BioZ的“ACI客观数值”,从胸片的“肺淤血定性描述”到“TFC量化标尺”,量化技术不仅减轻了医生的操作与分析负担,更以“标准化、可重复”的特性消除了主观偏差,让临床决策更精准、更高效。
在精准医疗成为主流的今天,量化血流动力学正以“数据”为笔,重新定义血流动力学监测的标准——未来,随着技术的持续迭代,我们终将实现“以最小的风险、最低的人力成本,获取最精准的血流动力学数据”,让每一位患者都能受益于“数据驱动”的精准守护。


